Soluções para registro de IVD no Brasil
Da Classe I à IV, o registro do seu dispositivo médico para diagnóstico in vitro na Anvisa requer conhecimento especializado, presença local e planejamento estratégico. Com a Sobel, você simplifica o processo, sem comprometer a conformidade.
Essa solução foi projetada para empresas que precisam registrar IVDs no Brasil:
Fabricantes de IVD
Procurando orientação especializada para registrar e manter seus produtos na Anvisa
Empresas internacionais
Em busca de orientação regulatória e representação local
Importadores e distribuidores
com documentação e notificação de produtos em conformidade com a Anvisa
Equipes de assuntos regulatórios
Buscando suporte técnico para a preparação de dossiês e submissões à Anvisa
O que é o registro de IVD na Anvisa?
Para comercializar legalmente seu IVD no Brasil, você deve seguir o caminho regulatório da Anvisa com base na RDC 830/2023. Os dispositivos são classificados por risco e processados por meio de notificação (Classe I/II) ou registro (Classe III/IV).
Mas navegar pelo processo de notificação de produtos IVD com a Anvisa pode ser complexo:

Quais documentos são necessários?
Isso depende do seu caminho regulatório, se você pretende nomear um detentor de registro brasileiro ou registrar o IVD diretamente no nome da sua empresa. Cada abordagem tem requisitos de documentação diferentes.
Na Sobel, iniciamos cada projeto com uma avaliação detalhada de sua estratégia regulatória. Com base em seus objetivos e na classificação do produto, nossa equipe prepara uma lista personalizada de documentos necessários, para que você tenha total clareza desde o início.
Quais são as expectativas para a rotulagem e a IFU?
A Anvisa exige que todos os produtos IVD incluam rotulagem e Instruções de Uso (IFU) em português do Brasil. Esses documentos devem descrever claramente o uso pretendido, o procedimento de teste, as condições de armazenamento, as advertências e quaisquer limitações - tudo em um formato de fácil compreensão para usuários profissionais ou leigos, dependendo do tipo de IVD.
A Sobel apoia sua equipe na preparação de rotulagem e conteúdo IFU, de acordo com as expectativas atuais da Anvisa, ajudando a agilizar seu processo de submissão.
Como você agrupa dispositivos semelhantes?
A Anvisa permite que determinados IVDs sejam agrupados em um único registro, desde que compartilhem características-chave, como o mesmo fabricante, marca, uso pretendido e princípios metodológicos.
No entanto, as regras de agrupamento podem ser complexas e variar de acordo com o tipo de IVD (por exemplo, reagentes, analisadores, software). Por isso, avaliamos o seu portfólio de produtos para definir a estratégia de registro mais eficiente, seja por meio de envios individuais ou de dossiês agrupados.
Quem pode atuar como seu representante brasileiro?
Para registrar os IVDs na Anvisa, os fabricantes estrangeiros devem nomear um detentor de registro brasileiro (BRH), que é uma empresa local legalmente estabelecida no Brasil e autorizada a representar o produto perante a autoridade reguladora.
A Sobel pode atuar como seu representante brasileiro, fornecendo suporte regulatório completo durante todo o ciclo de vida do seu produto no Brasil.
É aí que uma consultoria especializada como a Sobel faz a diferença. Nós mapeamos o seu caminho, preparamos o seu dossiê e representamos o seu produto perante a Anvisa.
Registro de IVD Anvisa
Você não precisa dominar todos os detalhes da RDC 830/2023 para registrar seu IVD no Brasil: afinal, a Sobel está aqui para orientá-lo.
Na Sobel, combinamos precisão técnica com visão estratégica para dar suporte ao seu registro de IVD no Brasil do início ao fim. Nossa equipe conhece a fundo as expectativas da Anvisa, incluindo os requisitos mais recentes da RDC 830/2023, e estamos preparados para orientar você, seja seu produto Classe I ou Classe IV.
Mais do que preencher documentos, ajudamos a definir o caminho regulatório mais eficiente para o seu dispositivo, adaptando nossa estratégia à classificação de risco, ao uso pretendido e à maturidade da documentação do seu produto.
Nós não te ajudamos apenas com os requisitos: ajudamos você a avançar mais rapidamente, evitar retrabalho e manter o foco na inovação, enquanto nós gerenciamos as complexidades regulatórias.
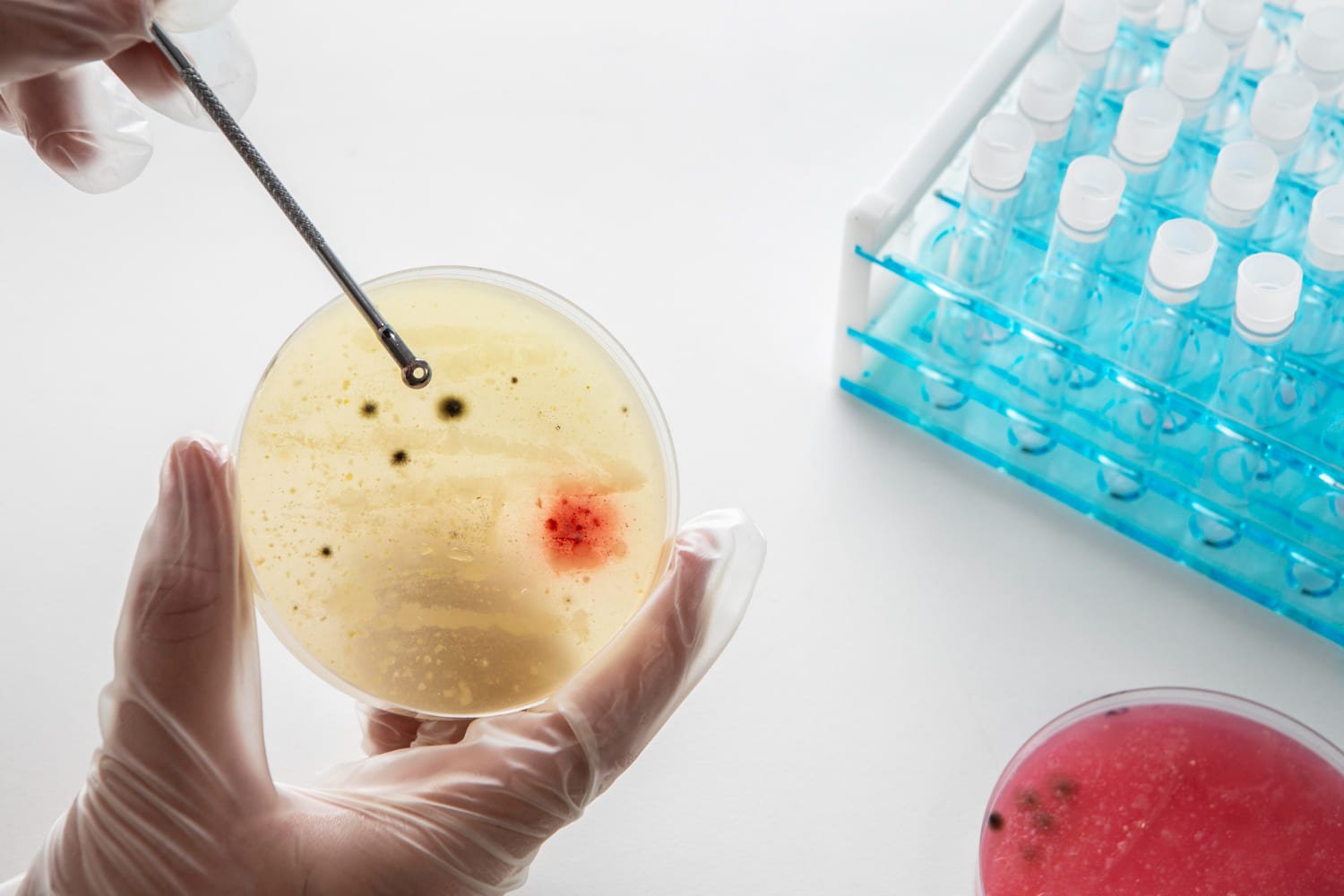
Nossos serviços para registro de IVD no Brasil
Descubra as principais etapas do processo de notificação e registro de produtos IVD na Anvisa e como a Sobel ajuda você:
Representante brasileiro IVD
Atuamos como seu representante oficial da Anvisa, gerenciando as responsabilidades de registro, conformidade e pós-comercialização.
Notificação e registro de IVD
Suporte estratégico para registrar ou notificar seu IVD no Brasil, com precisão regulatória, preparação de documentos e gerenciamento do processo.

Um parceiro confiável, suporte de ponta a ponta
Com a Sobel, sua empresa ganha um parceiro confiável que entende o ambiente regulatório local e oferece suporte de ponta a ponta, desde a classificação e a preparação do dossiê até o acompanhamento e as mudanças pós-comercialização.
Trabalhando juntos, seguindo nosso cronograma, você pode esperar:
Um envio completo e em conformidade
Redução do risco de atrasos ou retrabalho
Tempo de comercialização mais rápido no Brasil
Suporte com representação legal e comunicação regulatória
Você está pronto para trazer seu IVD para o Brasil?
A Sobel é o seu parceiro regulatório para um processo de registro tranquilo, estratégico e em total conformidade com a Anvisa. Fale com nossos consultores e descubra como o seu processo de notificação de produtos IVD com a Anvisa pode ser gerenciado com confiança e precisão.





